Apuntes teóricos

Unidades Químicas
A. Peso atómico:
El peso atómico es el número asignado a cada elemento químico para especificar la masa promedio de sus átomos. Puesto que un elemento puede tener dos o más isótopos cuyas masas difieren, el peso atómico de tal elemento dependerá de las proporciones relativas de sus isótopos. La composición isotópica de los elementos que se encuentran en la naturaleza es casi constante, excepto en aquellos que ha producido la radiactividad natural. El peso atómico se refiere a esta mezcla natural. En 1960 se introdujo una unidad llamada masa nuclear relativa, definida como 1/12 de la masa de carbono- 12. Se representa con el símbolo u; de este modo, 12C = 12u. La tabla de los pesos atómicos relativos se basa ahora en la masa atómica de 12C = 12. V
Así mismo, la masa molar de una molécula es la masa de un mol de esas moléculas (sus unidades en química son g/mol). Por definición un mol es el número de átomos que están contenidos en exactamente 12 gramos de carbono de masa isotópica 12 (12C). Este número se denomina número de Abogadro, y el valor más exacto que se conoce hasta ahora de él es de 6,0221367x1023.
Existen cuatro métodos de precisión para determinar los pesos atómicos, y en los casos más favorables todos ellos son comparables en exactitud:
1) combinación química de pesos.
2) densidades límite de gases.
3) mediciones en espectrómetros de masas.
4) energías de una reacción nuclear.
Las dos primeras producen resultados en la escala química y las dos últimas en la escala física.
6.022x10^23= Numero AVOGADRO
Así mismo, la masa molar de una molécula es la masa de un mol de esas moléculas (sus unidades en química son g/mol). Por definición un mol es el número de átomos que están contenidos en exactamente 12 gramos de carbono de masa isotópica 12 (12C). Este número se denomina número de Abogadro, y el valor más exacto que se conoce hasta ahora de él es de 6,0221367x1023.
Existen cuatro métodos de precisión para determinar los pesos atómicos, y en los casos más favorables todos ellos son comparables en exactitud:
1) combinación química de pesos.
2) densidades límite de gases.
3) mediciones en espectrómetros de masas.
4) energías de una reacción nuclear.
Las dos primeras producen resultados en la escala química y las dos últimas en la escala física.
6.022x10^23= Numero AVOGADRO
B. Átomo gramo:
El átomo gramo, es el peso en átomos de un mol de átomos (6,022 x 1023 átomos) de un elemento. Este peso es exactamente igual al peso atómico expresado en gramos.
1 At - g = P.A. g
Para realizar cálculos, tendremos que usar la siguiente relación:
Ejemplo:
Calcular el peso de un átomo de carbono en gramos. Dato: P.A. (C) = 12 uma
Solución:
Según la relación:
1 At-g (C) = 12 g (C) → 6,022 x 1023 átomos de (C)
Vemos que: 6,022 x 1023 átomos de (C) pesa 12 gramos.
Tenemos que calcular cuánto pesa 1 átomo de (C).
C. Peso Molecular:
El peso molecular es la suma de los pesos atómicos que entran en la fórmula molecular de un compuesto. Para averiguarlo toma la formula molecular del compuesto, toma los pesos atómicos que lo componen y multiplica cada peso por el subíndice. Mira la tabla periódica multiplica la MASA ATOMICA POR EL NUMERO ATOMICO.
El peso molecular (P.M.) es un antiguo término para lo que ahora es llamado más correctamente masa molar relativa (Mr). Es una cantidad a dimensional igual a la masa molar dividida por la constante demasa molar. La definición técnica es que la masa molar relativa es una masa molar medida en una escala donde la masa molar de un átomos no enlazados de carbono - 12, en reposo y en su estado fundamental, es 12. La primera definición es equivalente a la completa debido a la manera en que esa definida la constante de masa molar.
D. Mol-Gramo:
El mol-gramo, es el peso en gramos de un mol de moléculas (6,022x1023 moléculas) de una sustancia química. Se determine expresando el peso molecular en gramos.
Importante:
Representación General:
Para efectos de cálculo tenemos la siguiente relación:
Ejemplo 1:
¿Cuánto pesa en gramos una molécula de agua?. Dato: M(H2O) = 18 una
Solución:
Veamos la relación:
1 Mol-gr (H2O) = 18 g (H2O) → 6,022 x 1023 átomos de (H2O)
Vemos que: 6,022 x 1023 moléculas de (H2O) pesa 18 gramos.
Tenemos que calcular cuánto pesa 1 molécula de (H2O).
Aplicando una regla de tres simple:
X = 18 / (6,022 x 1023)
X = 3 x 10-23 gramos.
E. Numero de Abogadro:
En un mol hay un número muy grande de partículas, dado el pequeño tamaño y masa de cada una de ellas. Pero, ¿cuántas?
El número de partículas que hay en un mol se llama número de Avogadro, NA, y es 6.023*1023 partículas por mol. ¿Por qué se ha elegido ese número?
Para determinar la masa que tiene un mol de cualquier sustancia, solamente hay que multiplicar la masa real de una partícula de esa sustancia por el número de partículas que hay en un mol.
Ya has visto en uno de los ejemplos resueltos que la masa de cada molécula de agua es de 3*10-23 g. Para saber la masa de una cantidad de sustancia de agua de un mol, simplemente multiplicas la masa de una molécula de agua por las moléculas que hay en un mol, el número de Avogadro.
(Un mol de agua) = 3*10-23 g/molécula * 6.023*1023 moléculas = 18 g
El número de Avogadro es el inverso del valor numérico de la unidad de masa atómica:
6.023*1023=1/1.667*10-24
De esta forma, se mantiene el mismo número para la masa relativa, la masa real y la masa de un mol (masa molar, M), aunque su significado es diferente.
mr(H2O)= 18 m(H2O)= 18 u M(H2O)= 18 g/mol
------------------------------------------------ º ----------------------------------------------------------------- º --------------------------------------
Características de la Clasificación periódica moderna de los elementos
A. Tabla Periódica Larga
En 1927 Henry Moseley descubre un modo práctico de hallar los números atómicos, se utiliza un criterio para ordenar a los elementos químicos. Se enunció: “Las propiedades físicas y químicas de los elementos son funciones periódicas de los números atómicos”. Es decir los elementos están ordenados en función creciente de sus números atómicos. La tabla periódica actual (forma larga) fue diseñada por Werner y es una modificación de la tabla de Mendeleiev. Los elementos se hallan distribuidos: En 7 filas denominadas (periodos). En 18columnas o familias, las cuales se ordenan en grupos; 8 grupos A y 8 grupos B.
Periodos: Son las filas horizontales, nos indican el último nivel de energía del elemento. Existen 7 periodos o niveles. Grupos: Son agrupaciones verticales, nos indican que poseen propiedades químicas semejantes, debido a que poseen los mismos electrones de valencia. En la tabla periódica están ordenados en grupos A y B.

C. Tabla Cuántica
Esta tabla sirve para deducir los números cuánticos están clasificados en 4 bloques según la posición de la electro diferencial y los bloques son: S, D, P y F.
Los elementos se encuentran también en 3 tipos que se indica en la parte inferior de las clases:
El bloque S y P se le llama elementos representativos y en una tabla periódica será el grupo o Familia A.
Los bloques estarán representados por el grupo I y II respectivamente.
Bloque /e elemento S1 1 IA.- H, Li, Na, K, Rb, Cs, Fr. S2 1 IIA.- Be, Mg, Ca, Ca, Sr, Ba y Ra
Estructura de la Tabla Cuántica.
En esta tabla sola hay una igualdad sobre la tabla Periódica que hay periodos, pero en esta tabla existen una serie de subniveles o clases se encuentran en la parte inferior de la tabla y son S, P, D, F y significan:
La S: circular La P: 3 ochos La D: 5 ochos La F: 7 ochos
Después encontramos otra serie de números cuánticos que se encuentran en la parte superior de la tabla y son:
La n: principal La l: secundario La m: magnético La s: spin.
Esta tabla su forma de localización es en forma de escalera se busca el elemento que se quiere encontrar después se sube hasta llegar al número que esta hasta al final del renglón objetivo se observa la parte inferior de la tabla que tipo de clase es, ya después se observa la parte superior de la tabla y donde se va encontrar los números cuánticos.

D. Carga Nuclear Efectiva
La carga nuclear efectiva es la carga positiva neta experimentada por un electrón en un átomo poli electrónico. El término "efectiva" se usa porque el efecto pantalla de los electrones más cercanos al núcleo evita que los electrones en orbitales superiores experimenten la carga nuclear completa. Es posible determinar la fuerza de la carga nuclear observando el número de oxidación del átomo.
En un átomo con un electrón, el electrón experimenta toda la carga del núcleo positivo. En este caso, la carga nuclear efectiva puede ser calculada usando la ley de Coulomb.
Sin embargo, en un átomo con muchos electrones, los electrones externos son, simultáneamente, atraídos al núcleo debido a su carga positiva, y repelidos por los electrones cargados negativamente. La carga nuclear efectiva en un electrón de este tipo de átomo está dada por la siguiente ecuación:
Zeff=Z−S Donde Z es el número atómico, y define tanto el número de protones en el núcleo como el total de electrones de un átomo.
S es la constante de pantalla, depende del número de electrones entre el núcleo y el electrón considerado, y también en qué tipo de orbital se encuentran los electrones que restan carga nuclear. No contribuyen los electrones exteriores al nivel energético considerado, pero sí el resto de los vecinos del mismo nivel.

E. Radio Atómico, Radio Covalente y Radio Iónico
• Radio Atómico: El radio atómico está totalmente definido como la mitad de la distancia entre dos núcleos de dos átomos adyacentes. Diferentes propiedades físicas, densidad, punto de fusión, punto de ebullición, están relacionadas con el tamaño de los átomos. Identifica la distancia que existe entre el núcleo y el orbital más externo de un átomo. Por medio del radio atómico, es posible determinar el tamaño del átomo.
• Radio Covalente: En química, se denomina radio covalente a la mitad de la distancia entre dos átomos iguales que forman un enlace covalente. Normalmente se expresa en picómetros (pm) o ángstroms (Å), donde 1 Å = 100 pm. La suma de dos radios covalentes debería ser la longitud del enlace covalente entre los dos átomos. Sin embargo, esta relación no se cumple de forma exacta ya que el tamaño de un átomo no es constante. Este depende del entorno químico donde se encuentre. Generalmente la longitud del enlace covalente tiende a ser menor que lo que la suma de radios covalentes. En consecuencia, los valores tabulados de radios covalentes que se encuentran en la bibliografía son valores idealizados o promediados.
• Radio Iónico: El radio iónico es, al igual que el radio atómico, la distancia entre el centro del núcleo del átomo y el electrón estable más alejado del mismo, pero haciendo referencia no al átomo, sino al ion. Éste aumenta en la tabla de derecha a izquierda por los periodos y de arriba hacia abajo en los grupos. En el caso de los cationes, la ausencia de uno o varios electrones disminuye la fuerza eléctrica de repulsión mutua entre los electrones restantes, provocando el acercamiento de los mismos entre sí y al núcleo positivo del átomo del que resulta un radio iónico menor que el atómico. En el caso de los aniones, el fenómeno es el contrario, el exceso de carga eléctrica negativa obliga a los electrones a alejarse unos de otros para restablecer el equilibrio de fuerzas eléctricas, de modo que el radio iónico es mayor que el atómico.
F. Energía de Ionización
La energía de ionización, potencial de ionización o E es la energía necesaria para separar un electrón en su estado fundamental de un átomo, de un elemento en estado de gas. La reacción puede expresarse de la siguiente forma:
A (g)+EI→A+(g) +1e¯.
Siendo A (g) los átomos en estado gaseoso de un determinado elemento químico; EI, la energía de ionización y e¯ un electrón.
Esta energía corresponde a la primera ionización. El segundo potencial de ionización representa la energía precisa para sustraer el segundo electrón; este segundo potencial de ionización es siempre mayor que el primero, pues el volumen de un ion positivo es menor que el del átomo y la fuerza electrostática atractiva que soporta este segundo electrón es mayor en el ion positivo que en el átomo, ya que se conserva la misma carga nuclear.
El potencial o energía de ionización se expresa en electronvoltios, julios o en kilojulios por mol (kJ/mol).
1 eV = 1,6 × 10-19 C × 1 V = 1,6 × 10-19 J
En los elementos de una misma familia o grupo, el potencial de ionización disminuye a medida que aumenta el número atómico, es decir, de arriba abajo.
Sin embargo, el aumento no es continuo, pues en el caso del berilio y el nitrógeno se obtienen valores más altos que lo que podía esperarse por comparación con los otros elementos del mismo periodo. Este aumento se debe a la estabilidad que presentan las configuraciones s2 y s2 p3, respectivamente.
La energía de ionización más elevada corresponde a los gases nobles, ya que su configuración electrónica es la más estable, y por tanto habrá que proporcionar más energía para arrancar los electrones.

G. Afinidad Electrónica
La afinidad electrónica (AE) o electroafinidad se define como la energía liberada cuando un átomo gaseoso neutro en su estado fundamental (de mínima energía) captura un electrón y forma un ion mononegativo:
X (p)+e−→X−(p)+AE.
Dado que se trata de energía liberada, pues normalmente al insertar un electrón en un átomo predomina la fuerza atractiva del núcleo, tiene signo negativo. En los casos en los que la energía sea absorbida, cuando ganan las fuerzas de repulsión, tendrán signo positivo; AE se expresa comúnmente en el Sistema Internacional de Unidades, en kJmol-1.
También podemos recurrir al proceso contrario para determinar la primera afinidad electrónica, ya que sería la energía consumida en arrancar un electrón a la especie aniónica mononegativa en estado gaseoso de un determinado elemento; evidentemente la entalpía correspondiente AE tiene signo negativo, salvo para los gases nobles y metales alcalinotérreos. Este proceso equivale al de la energía de ionización de un átomo, por lo que la AE sería por este formalismo la energía de ionización de orden cero.
Esta propiedad nos sirve para prever qué elementos generarán con facilidad especies aniónicas estables, aunque no hay que relegar otros factores: tipo de contraión, estado sólido, ligando-disolución, etc.

H. Número de Oxidación
El número de oxidación es un número entero que representa el número de electrones que un átomo recibe (signo menos) o que pone a disposición de otros (signo más) cuando forma un compuesto determinado.
Eso significa que el número de oxidación es positivo si el átomo pierde electrones, o los comparte con un átomo que tenga tendencia a captarlos. Y será negativo cuando el átomo gane electrones, o los comparta con un átomo que tenga tendencia a cederlos.
El número de oxidación se escribe en números romanos: +I, +II, +III, +IV, -I, -II, -III, -IV, etc. Pero en esta explicación usamos caracteres arábigos para referirnos a ellos: +1, +2, +3, +4, -1, -2, -3, -4 etcétera, lo cual nos facilitará los cálculos al tratarlos como números enteros.
Importante
Más arriba dijimos que el número de oxidación es distinto al número de carga, pero debemos agregar que en los iones monoatómicos (de un átomo) la carga eléctrica coincide con el número de oxidación. Por ello es imprescindible recalcar que cuando nos refiramos al número de oxidación el signo + o – lo escribiremos a la izquierda del número, como en los números enteros. Por otra parte, la carga de los iones, o número de carga, se debe escribir con el signo a la derecha del dígito: Ca2+ ión calcio (2+), CO32− ión carbonato (2−).
Elemento Nº oxidación
Único Con el H y con los metales En los oxácidos
Li, Na, K, Rb, Cs, Fr, Ag, NH4+ (amonio) + 1
Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd + 2
B, Al, Ga, In, Tl, Sc, Y, La + 3
F − 1
Cl, Br, I − 1 + 1, + 3, + 5, + 7
S, Se, Te − 2 + 4, + 6
O − 2 + 4, + 6
O en peróxidos (Como en H2O2) − 1
N, P, As, Sb, Bi − 3 + 3, + 5

I. Electronegatividad
La electronegatividad es una medida de la capacidad de un átomo (o de manera menos frecuente un grupo funcional) para atraer a los electrones, cuando forma un enlace químico en una molécula.1 También debemos considerar la distribución de densidad electrónica alrededor de un átomo determinado frente a otros distintos, tanto en una especie molecular como en sistemas o especies no moleculares. El flúor es el elemento con más electronegatividad, el Francio es el elemento con menos electronegatividad.
La electronegatividad de un átomo determinado está afectada fundamentalmente por dos magnitudes: su masa atómica y la distancia promedio de los electrones de valencia con respecto al núcleo atómico. Esta propiedad se ha podido correlacionar con otras propiedades atómicas y moleculares. Fue Linus Pauling el investigador que propuso esta magnitud por primera vez en el año 1932, como un desarrollo más de su teoría del enlace de valencia.2 La electronegatividad no se puede medir experimentalmente de manera directa como, por ejemplo, la energía de ionización, pero se puede determinar de manera indirecta efectuando cálculos a partir de otras propiedades atómicas o moleculares.
Se han propuesto distintos métodos para su determinación y aunque hay pequeñas diferencias entre los resultados obtenidos todos los métodos muestran la misma tendencia periódica entre los elementos.
El procedimiento de cálculo más común es el inicialmente propuesto por Pauling. El resultado obtenido mediante este procedimiento es un número adimensional que se incluye dentro de la escala de Pauling. Esta escala varía entre 0,7 para el elemento menos electronegativo y 4,0 para el mayor.
Impacto Económico o Ambiental de algunos Elementos
A. Abundancia de los elementos en la naturaleza
Comúnmente se agrupan los elementos en Metales y No-Metales. Los metales son elementos que tienen generalmente brillo metálico, son maleables, dúctiles, buenos conductores del calor y de la electricidad; la propiedad fundamental que justifica la clasificación, es que sus óxidos al combinarse con el agua forman hidróxidos. Los no-metales son elementos químicos que con el oxígeno forman óxidos, que se combinan con el agua para constituir ácidos; estos óxidos se conocen con el nombre de anhídridos.
La tabla periódica nos muestra que los elementos están agrupados de modo tal que parece indicar su distribución en la naturaleza. En la parte superior están los gases que constituyen la atmósfera como en nitrógeno y el oxígeno. En el centro están las sales y el agua, si se toma en cuenta que los extremos de la tabla se cierran y se unen los metales alcalinos con los halógenos.
En la parte inferior están los metales que en forma de minerales se encuentran en el interior de la tierra.

B. Elementos de importancia económica
Combustibles y carburantes. Los combustibles son cuerpos capaces de combinarse con él oxigeno con desprendimiento de calor. Los productos de la combustión son generalmente gaseosos.
Por razones prácticas, la combustión no debe ser ni muy rápida ni demasiado lenta. Puede hacerse una distinción entre los combustibles quemados en los hogares y los carburantes utilizados en los motores de explosión; aunque todos los carburantes pueden ser empleados como combustibles, no ocurre lo mismo a la viceversa.
Clasificación y utilización de los combustibles: Los distintos combustibles y carburantes utilizados pueden ser: sólidos, líquidos o gaseosos. Combustibles sólidos. Carbones naturales: Los carbones naturales proceden de la transformación lenta, fuera del contacto con el aire, de grandes masas vegetales acumuladas en ciertas regiones durante las épocas geológicas.
El proceso de carbonización, en unos casos, muy antiguo, además de que influyen otros factores, como las condiciones del medio ambiente y el tipo de vegetal original.
Se han emitido numerosas teorías para explicar la formación de las minas de carbón, pero ninguna es totalmente satisfactoria. Madera: La madera se utiliza sobre todo en la calefacción domestica. En los hogares industriales, salvo en los países en que es muy abundante, no suele emplearse. Combustibles líquidos. Petróleo: Se encuentra en ciertas regiones del globo (Estados Unidos, Venezuela, U.R.S.S., etc.) en yacimientos subterráneos, se extrae haciendo perforaciones que pueden alcanzar los 7000 m de profundidad.
C. Elementos contaminantes
C. Elementos contaminantes
· Antimonio: El antimonio se emplea en aleaciones, metal de imprenta, baterías, cerámica y textiles. El envenenamiento se produce por ingestión, inhalación de vapores y principalmente por un gas llamado estibina.
· Arsénico: Se emplea en venenos para hormigas, insecticidas, pinturas, medicamentos y vidrio. Es uno de los elementos más venenosos que hay.
· Azufre: Principalmente sus óxidos SO2 Y SO3 contaminan el aire y con agua producen la lluvia ácida. Substancias tales como derivados clorados de azufre, sulfatos, ácidos, son corrosivos. El gas H2S es sumamente tóxico y contaminan el aire. El azufre es empleado en algunos medicamentos para la piel.
· Bromo: Sus vapores contaminan el aire, además sus compuestos derivados son lacrimógenos y venenosos.
· Cadmio: Metal tóxico que se origina en la refinación del zinc; también proviene de operaciones de electrodeposición y por tanto contamina agua y aire. Contenido en algunos fertilizantes y contamina el suelo.
· Cloro: Sus vapores contaminan el aire y son corrosivos. Se le emplea en forma de cloratos para blanquear la ropa, para lavados bucales, para cerillos. Los cloratos son solubles en agua y la contaminan además de formar mezclas explosivas con compuestos orgánicos.
· Cromo: El cromo y sus compuestos son perjudiciales al organismo, pues destruyen todas las células. Se le emplea en síntesis orgánicas y en la industria del acero. Un cromato soluble contamina el agua.
· Fósforo: El fósforo blanco o amarillo es muy venenoso. El fósforo rojo no lo es, pero se encuentra contaminado por el blanco. Se emplea fósforo en síntesis, pinturas, fertilizantes, plaguicidas, ocasionando contaminación de aire, suelo y agua. El gas PH3 es muy venenoso y los vapores de compuestos orgánicos fosforados contaminan el aire.
-------------------------------------------------------- º ------------------------------------------------------- º -----------------------------------------La tabla periódica larga
La tabla periódica de los elementos ampliada fue sugerida por primera vez por Glenn Theodore Seaborg en 1969. Se considera una extensión lógica de los principios que hicieron posible latabla periódica, de tal forma que sea posible incluir fácilmente los elementos químicos no descubiertos aún. Todos los elementos se denominan según los postulados de la Unión Internacional de Química Pura y Aplicada (la IUPAC, siglas de su nombre en inglés: International Union of Pure and Applied Chemistry), que proporciona una denominación sistemática de elementos estándar mientras no se confirme un nombre oficial.

Los renglones de la tabla periódica se llaman períodos, pues de su longitud depende la periodicidad con que se repiten las propiedades similares según la ley periódica. Debe notarse que los períodos tienen diferente longitud, así el primer período sólo contiene dos elementos (Hidrógeno y Helio), en tanto que el segundo período contiene 8 elementos y el cuarto 18. Adviértase además, que esta longitud está en relación directa con el número de electrones que caben en las diferentes capas de Bohr, y con el número de electrones que se pueden describir con un valor dado del número cuántico principal en el modelo de Schrödinger.
- El volumen atómico: es el volumen que ocupa un mol de átomo del elemento considerado. El volumen atómico aumenta con el número atómico en elementos del mismo grupo (por ejemplo, el del potasio será mayor que el del sodio, etc.)
Los grupos con mayor volumen atómico son los metales del bloque s, después los no metales, y finalmente los metales de transición. En un periodo disminuye hacia la derecha de la tabla periódica, salvo en los elementos cobre, zinc y galio donde el volumen aumenta y los volúmenes atómicos tienen una relación con la periodicidad química.

- Punto de fusión: (o, punto de licuefacción) es la temperatura a la cual se encuentra el equilibrio de fases sólido-líquido, es decir la materia pasa de estado sólido a estado líquido, se funde. Cabe destacar que el cambio de fase ocurre a temperatura constante. El punto de fusión es una propiedad intensiva.
En la mayoría de las sustancias, el punto de fusión y de congelación, son iguales. Pero esto no siempre es así: por ejemplo, el agar-agar se funde a 85 °C y se solidifica a partir de los 31 °C a 40 °C; este proceso se conoce como histéresis.
|
Punto de fusión (ºC)
|
Elemento
|
Símbolo
|
Número atómico
|
|
-272
|
He
|
2
|
|
|
-259
|
H
|
1
|
|
|
-249
|
Ne
|
10
|
|
|
-220
|
F
|
9
|
|
|
-218
|
O
|
8
|
|
|
-210
|
N
|
7
|
|
|
-189
|
Ar
|
18
|
|
|
-157
|
Kr
|
36
|
|
|
-112
|
Xe
|
54
|
|
|
-101
|
Cl
|
17
|
|
|
-71
|
Rn
|
86
|
|
|
-39
|
Hg
|
80
|
|
|
-7
|
Br
|
35
|
|
|
27
|
Fr
|
87
|
|
|
29
|
Cs
|
55
|
|
|
30
|
Ga
|
31
|
|
|
39
|
Rb
|
37
|
|
|
44
|
P
|
15
|
|
|
64
|
K
|
19
|
|
|
81
|
As
|
33
|
|
|
98
|
Na
|
11
|
|
|
113
|
S
|
16
|
|
|
113.5
|
I
|
53
|
|
|
157
|
In
|
49
|
|
|
180
|
Li
|
3
|
|
|
217
|
Se
|
34
|
|
|
232
|
Sn
|
50
|
|
|
254
|
Po
|
84
|
|
|
271
|
Bi
|
83
|
|
|
302
|
At
|
85
|
|
|
303
|
Tl
|
81
|
|
|
321
|
Cd
|
48
|
|
|
327
|
Pb
|
82
|
|
|
420
|
Zn
|
30
|
|
|
449.6
|
Te
|
52
|
|
|
630
|
Sb
|
51
|
|
|
639
|
Mg
|
12
|
|
|
640
|
Np
|
93
|
|
|
640
|
Pu
|
94
|
|
|
660
|
Al
|
13
|
|
|
700
|
Ra
|
88
|
|
|
725
|
Ba
|
56
|
|
|
769
|
Sr
|
38
|
|
|
795
|
Ce
|
58
|
|
|
822
|
Eu
|
63
|
|
|
824
|
Yb
|
70
|
|
|
827
|
No
|
102
|
|
|
839
|
Ca
|
20
|
|
|
860
|
Es
|
99
|
|
|
900
|
Cf
|
98
|
|
|
920
|
La
|
57
|
|
|
935
|
Pr
|
59
|
|
|
937
|
Ge
|
32
|
|
|
962
|
Ag
|
47
|
|
|
986
|
Bk
|
97
|
|
|
994
|
Am
|
95
|
|
|
1010
|
Nd
|
60
|
|
|
1050
|
Ac
|
89
|
|
|
1064
|
Au
|
79
|
|
|
1072
|
Sm
|
62
|
|
|
1083
|
Cu
|
29
|
|
|
1100
|
Pm
|
61
|
|
|
1132
|
U
|
92
|
|
|
1245
|
Mn
|
25
|
|
|
1278
|
Be
|
4
|
|
|
1311
|
Gd
|
64
|
|
|
1340
|
Cm
|
96
|
|
|
1360
|
Tb
|
65
|
|
|
1410
|
Si
|
14
|
|
|
1412
|
Dy
|
66
|
|
|
1453
|
Ni
|
28
|
|
|
1470
|
Ho
|
67
|
|
|
1495
|
Co
|
27
|
|
|
1522
|
Er
|
68
|
|
|
1523
|
Y
|
39
|
|
|
1527
|
Fm
|
100
|
|
|
1535
|
Fe
|
26
|
|
|
1539
|
Sc
|
21
|
|
|
1545
|
Tm
|
69
|
|
|
1552
|
Pd
|
46
|
|
|
1568
|
Pa
|
91
|
|
|
1627
|
Lr
|
103
|
|
|
1656
|
Lu
|
71
|
|
|
1660
|
Ti
|
22
|
|
|
1750
|
Th
|
90
|
|
|
1772
|
Pt
|
78
|
|
|
1852
|
Zr
|
40
|
|
|
1857
|
Cr
|
24
|
|
|
1890
|
V
|
23
|
|
|
1966
|
Rh
|
45
|
|
|
2150
|
Hf
|
72
|
|
|
2200
|
Tc
|
43
|
|
|
2250
|
Ru
|
44
|
|
|
2300
|
B
|
5
|
|
|
2410
|
Ir
|
77
|
|
|
2468
|
Nb
|
41
|
|
|
2617
|
Mo
|
42
|
|
|
2996
|
Ta
|
73
|
|
|
3045
|
Os
|
76
|
|
|
3180
|
Re
|
75
|
|
|
3410
|
W
|
74
|
|
|
3500
|
C
|
6
|
|
-Punto de ebullición: es aquella temperatura en la cual la presión de vapor del líquido iguala a la presión de vapor del medio en el que se encuentra. Coloquialmente, se dice que es la temperatura a la cual la materia cambia del estado líquido al estado gaseoso.
|
Punto de ebullición (ºC)
|
Elemento
|
Símbolo
|
Número atómico
|
|
-269
|
He
|
2
|
|
|
-253
|
H
|
1
|
|
|
-246
|
Ne
|
10
|
|
|
-196
|
N
|
7
|
|
|
-188
|
F
|
9
|
|
|
-186
|
Ar
|
18
|
|
|
-183
|
O
|
8
|
|
|
-153
|
Kr
|
36
|
|
|
-108
|
Xe
|
54
|
|
|
-62
|
Rn
|
86
|
|
|
-35
|
Cl
|
17
|
|
|
59
|
Br
|
35
|
|
|
184
|
I
|
53
|
|
|
280
|
P
|
15
|
|
|
337
|
At
|
85
|
|
|
357
|
Hg
|
80
|
|
|
445
|
S
|
16
|
|
|
613
|
As
|
33
|
|
|
677
|
Fr
|
87
|
|
|
678
|
Cs
|
55
|
|
|
685
|
Se
|
34
|
|
|
688
|
Rb
|
37
|
|
|
765
|
Cd
|
48
|
|
|
774
|
K
|
19
|
|
|
883
|
Na
|
11
|
|
|
907
|
Zn
|
30
|
|
|
962
|
Po
|
84
|
|
|
990
|
Te
|
52
|
|
|
1090
|
Mg
|
12
|
|
|
1140
|
Ba
|
56
|
|
|
1347
|
Li
|
3
|
|
|
1384
|
Sr
|
38
|
|
|
1457
|
Tl
|
81
|
|
|
1466
|
Yb
|
70
|
|
|
1484
|
Ca
|
20
|
|
|
1560
|
Bi
|
83
|
|
|
1597
|
Eu
|
63
|
|
|
1727
|
Tm
|
69
|
|
|
1737
|
Ra
|
88
|
|
|
1740
|
Pb
|
82
|
|
|
1750
|
Sb
|
51
|
|
|
1900
|
Sm
|
62
|
|
|
1962
|
Mn
|
25
|
|
|
2000
|
In
|
49
|
|
|
2212
|
Ag
|
47
|
|
|
2270
|
Sn
|
50
|
|
|
2355
|
Si
|
14
|
|
|
2403
|
Ga
|
31
|
|
|
2467
|
Al
|
13
|
|
|
2510
|
Er
|
68
|
|
|
2550
|
B
|
5
|
|
|
2562
|
Dy
|
66
|
|
|
2567
|
Cu
|
29
|
|
|
2607
|
Am
|
95
|
|
|
2672
|
Cr
|
24
|
|
|
2720
|
Ho
|
67
|
|
|
2732
|
Ni
|
28
|
|
|
2750
|
Fe
|
26
|
|
|
2807
|
Au
|
79
|
|
|
2830
|
Ge
|
32
|
|
|
2832
|
Sc
|
21
|
|
|
2870
|
Co
|
27
|
|
|
2927
|
Pd
|
46
|
|
|
2970
|
Be
|
4
|
|
|
3000
|
Pm
|
61
|
|
|
3041
|
Tb
|
65
|
|
|
3127
|
Pr
|
59
|
|
|
3127
|
Nd
|
60
|
|
|
3200
|
Ac
|
89
|
|
|
3233
|
Gd
|
64
|
|
|
3235
|
Pu
|
94
|
|
|
3257
|
Ce
|
58
|
|
|
3287
|
Ti
|
22
|
|
|
3315
|
Lu
|
71
|
|
|
3337
|
Y
|
39
|
|
|
3380
|
V
|
23
|
|
|
3469
|
La
|
57
|
|
|
3727
|
Rh
|
45
|
|
|
3818
|
U
|
92
|
|
|
3827
|
Pt
|
78
|
|
|
3900
|
Ru
|
44
|
|
|
3902
|
Np
|
93
|
|
|
4377
|
Zr
|
40
|
|
|
4527
|
Ir
|
77
|
|
|
4612
|
Mo
|
42
|
|
|
4790
|
Th
|
90
|
|
|
4827
|
C
|
6
|
|
|
4877
|
Tc
|
43
|
|
|
4927
|
Nb
|
41
|
|
|
5027
|
Os
|
76
|
|
|
5400
|
Hf
|
72
|
|
|
5425
|
Ta
|
73
|
|
|
5627
|
Re
|
75
|
|
|
5660
|
W
|
74
|
Un óxido es un compuesto binario que contiene uno o varios átomos de oxígeno (el cual, normalmente, presenta un estado de oxidación -2),1 y otros elementos. Existe una gran variedad de óxidos,los cuales se presentan en los 3 principales estados de agregación de la materia: sólido, líquido y gaseoso, a temperatura ambiente. Casi todos los elementos forman combinaciones estables con oxígeno y muchos en varios estados de oxidación. Debido a esta gran variedad las propiedades son muy diversas y las características del enlace varían desde el típico sólido iónico hasta los enlaces covalentes.
Según la estequiometria del compuesto:
-Óxidos binarios: formados por oxígeno y otro elemento.
-Óxidos mixtos: formados por dos elementos distintos y oxígeno como son las espinelasitas.
Atendiendo al comportamiento químico hay tres tipos de óxidos: óxidos básicos, ácidos y óxidos anfóteros, aunque no muy comunes en la naturaleza.
-óxidos básicos: se forman con un metal más oxígeno, los óxidos de elementos menos electronegativos tienden a ser básicos. Se les llaman también anhídridos básicos; ya que al agregar agua, pueden formar hidróxidos básicos. Por ejemplo:
Na2O+H2O→2Na(OH)
-Óxidos ácidos: son los formados con un no metal + oxígeno, los óxidos de elementos más electronegativos tienden a ser ácidos. Se les llaman también anhídridos ácidos (nomenclatura en desuso); ya que al agregar agua, forman oxácidos. Por ejemplo:
CO2+H2O→H2CO3
-Óxidos anfotéricos: se forman cuando participa en el compuesto un elemento anfótero. Los anfóteros son óxidos que pueden actuar como ácido o base según con lo que se les haga reaccionar. Su electronegatividad tiende a ser neutra y estable, tiene punto de fusión bajo y tienen diversos usos. Un ejemplo es óxido de aluminio.
Algunos óxidos no demuestran comportamiento como ácido o base.
Un halogenuro o haluro, (derivado del nombre griego halos = sal), es un compuesto binario en el cual una parte es un átomo halógeno y la otra es un elemento, catión o grupo funcional que es menos electronegativo que el halógeno. Según el átomo halógeno que forma el haluro éste puede ser un fluoruro, cloruro, bromuro o yoduro, todos elementos del grupo XVII en estado de oxidación -1. Sus características químicas y físicas se suelen parecer para el cloruro hasta el yoduro siendo una excepción el fluoruro.
Tipos de halogenuros:
-Halogenuros inorgánicos: son sales que contienen los iones F-, Cl-, Br- o I-. Con iones plata forman un precipitado (excepto el fluoruro, que es soluble). La solubilidad de la sal de plata decae con el peso del halogenuro. Al mismo tiempo aumenta el color que va de blanco para el cloruro AgCl a amarillo en el AgI.
También existen complejos metálicos de los halogenuros. Así, el yoduro de mercurio se disuelve en presencia de un exceso de yoduro para formar aniones de tetrayodomercurato HgI42-. (Este ion se encuentra por ejemplo en el reactivo de Nessler utilizado en la determinación cualitativa del amoníaco).
-Halogenuros orgánicos: cuentan con un halógeno en estado de oxidación, unido directamente a un átomo de carbono. Según la naturaleza del halógeno y del resto orgánico tienen una amplia variedad de aplicaciones y se han desarrollado diversas formas de síntesis.
--------------------------------------------------- º ------------------------------------------------- º ------------------------------------------

--------------------------------------------------- º ------------------------------------------------- º ------------------------------------------
Enlace Químico
Es el proceso responsable de las interacciones entre átomos, moléculas e iones, que tiene una estabilidad en los compuestos químicos diatómicos y poliatómicos. El enlace químico fuerte está asociado en la transferencia de electrones entre los átomos participantes. Las moléculas, cristales, y gases diatómicos (estos forman la mayor parte del ambiente físico que nos rodea) y todos estan unidos por enlaces químicos, que determinan las propiedades físicas y químicas de la materia.
Las cargas opuestas se atraen, porque, al estar unidas, adquieren una situación más estable que cuando estaban separados. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles ya que los electrones que orbitan el núcleo están cargados negativamente, y que los protones en el núcleo lo están positivamente, la configuración más estable del núcleo y los electrones es una en la que los electrones pasan la mayor parte del tiempo entre los núcleos, que en otro lugar del espacio. Estos electrones hacen que los núcleos se atraigan mutuamente.

SIMBOLO ELECTRONICO
La estructura de Lewis también son conocidas como electrón-punto, son una forma útil de mostrar los electrones de valencia de los átomos y de seguirle la pista durante la formulación de enlace. El símbolo de lewis para un elemento consiste en el símbolo química del elemento mas un punto por cada electrón de valencia. El numero de electrones de valencia de cualquier elemento es el mismo que el grupo en el que esta el elemento en la tabla periódica. Los atomos con frecuencia ganan, pierden o comparten electrones tratando de alcanzar el mismo numero de electrones que el gas noble mas cercano a el. Por ejemplo, el azufre se encuentra en el grupo VI A por lo tanto su simbolo de lewis muestra 6 electrones de valencia.
La regla del octeto es aquella que establece que todos los átomos tienden a ganar, perder o compartir electrones hasta estar rodeado por ocho electrones de valencia. Puesto que todos los gases nobles, a excepción del helio, tiene ocho electrones de valencia, el átomo va a adoptar la configuración del mismo, y esta es la configuración electrónica más estable. Hay muchas excepciones de la regla del octeto, pero ofrecen un marco de referencia útil para introducir muchos conceptos de enlaces importantes.
ESTRUCTURA DE LEWIS
También llamada diagrama de punto, modelo de Lewis o representación de Lewis, es una representación gráfica que muestra los pares de electrones de enlaces entre los átomos de una molécula y los pares de electrones solitarios que puedan existir. Son representaciones adecuadas y sencillas de iones y compuestos, que facilitan el recuento exacto de electrones y constituyen una base importante para predecir estabilidades relativas. Esta representación se usa para saber la cantidad de electrones de valencia de un elemento que interactúan con otros o entre su misma especie, formando enlaces ya sea simples, dobles, o triples y estos se encuentran íntimamente en relación con los enlaces químicos entre las moléculas y su geometría molecular, y la distancia que hay entre cada enlace formado.
Las estructuras de Lewis muestran los diferentes átomos de una determinada molécula usando su símbolo químico y líneas que se trazan entre los átomos que se unen entre sí. En ocasiones, para representar cada enlace, se usan pares de puntos en vez de líneas. Los electrones desapartados (los que no participan en los enlaces) se representan mediante una línea o con un par de puntos, y se colocan alrededor de los átomos a los que pertenece.

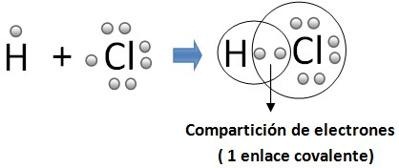
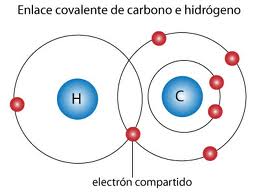
ENLACE COVALENTE
Un enlace covalente entre dos átomos o grupos de átomos se produce cuando estos átomos se unen, para alcanzar el octeto estable, comparten electrones del último nivel.1 La diferencia de electronegatividades entre los átomos no es lo suficientemente grande como para que se produzca una unión de tipo iónica, en cambio, solo es posible la compartición de electrones con el fin de alcanzar la mayor estabilidad posible; para que un enlace covalente se genere es necesario que el delta de electronegatividad sea menor a 1,7.
El enlace covalente polar es intermediado en su carácter entre un enlace covalente y un enlace iónico. Los enlaces covalentes polares se forman con átomos distintos con gran diferencia de electronegatividades. La molécula es eléctricamente neutra, pero no existe simetría entre las cargas eléctricas originando la polaridad, un extremo se caracteriza por ser electropositivo y el otro electronegativo.
Los enlaces covalentes no polares se forman entre átomos iguales, no hay variación en el número de oxidación. Los átomos enlazados de esta forma tienen carga eléctrica neutra. Cuando el enlace lo forman dos átomos del mismo elemento, la diferencia de electronegatividad es cero, entonces se forma un enlace covalente no polar. El enlace covalente no polar se presenta entre átomos del mismo elemento o entre átomos con muy poca diferencia de electronegatividad. Un ejemplo es la molécula de hidrógeno, la cual está formada por dos átomos del mismo elemento, por lo que su diferencia es cero. Otro ejemplo, pero con átomos diferentes, es el metano. La electronegatividad del carbono es 2.5 y la del hidrógeno es 2.1; la diferencia entre ellos es de 0.4 (menor de 0.5), por lo que el enlace se considera no polar. Además el metano es una molécula muy simétrica, por lo que las pequeñas diferencias de electronegatividad en sus cuatro enlaces se anulan entre sí.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Los metales generalmente presentan brillo y son maleables. Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen. La vinculación metálica es no polar, apenas hay diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación (en los metales, elementales puros) o muy poca (en las aleaciones), y los electrones implicados en lo que constituye la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales como maleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y con brillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).