Apuntes Teóricos.

1. La Medición en la Química y su uso para la resolución de problemas
El sistema internacional de Unidades de Medida:
El Sistema Internacional de Unidades, abreviado SI, es el sistema de unidades que se usa en casi todos los países.
Es el heredero del antiguo Sistema Métrico Decimal y por ello también se conoce como «sistema métrico», especialmente por las personas
de más edad y en las pocas naciones donde aún no se ha implantado para uso cotidiano.
Se instauró en 1960, en la XI Conferencia General de Pesas y Medidas, durante la cual inicialmente se reconocieron seis unidades físicas básicas. En 1971 se añadió la séptima unidad básica: el mol.
Una de las características trascendentales, que constituye la gran ventaja del Sistema Internacional, es que sus unidades se basan en fenómenos físicos fundamentales. Excepción única es la unidad de la magnitud masa, el kilogramo, definida como «la masa del prototipo internacional del kilogramo», un cilindro de platino e iridio almacenado en una caja fuerte de la Oficina Internacional de Pesas y Medidas.
Las unidades del SI constituyen referencia internacional de las indicaciones de los instrumentos de medición, a las cuales están referidas mediante una concatenación ininterrumpida de calibraciones o comparaciones.
Esto permite lograr equivalencia de las medidas realizadas con instrumentos similares, utilizados y calibrados en lugares distantes y, por ende, asegurar —sin necesidad de duplicación de ensayos y mediciones— el cumplimiento de las características de los productos que son
objeto de transacciones en el comercio internacional, su intercambiabilidad.
Entre los años 2006 y 2009 el SI se unificó con la norma ISO 31 para instaurar el Sistema Internacional de Magnitudes (ISO/IEC 80000,
con las siglas ISQ).
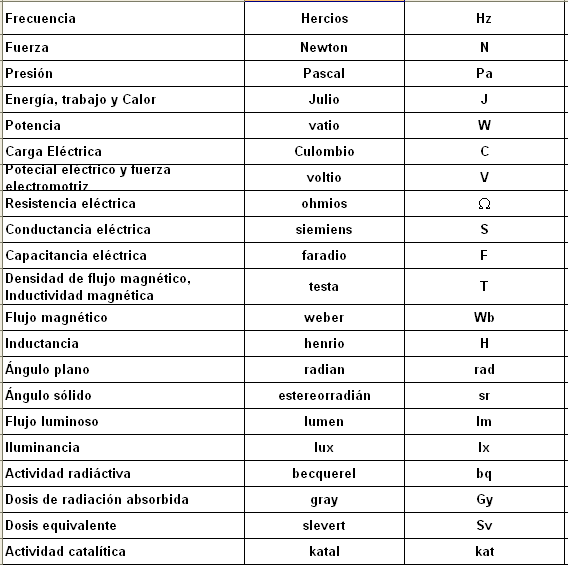
-Magnitudes Fundamentales y derivadas:
Magnitudes Fundamentales:

Derivadas:
A. Reseña histórica de los modelos atómicos:
Los modelos Atómicos son una representación estructural de un átomo que explica las propiedades y comportamientos del mismo; no debe ser considerado como un dibujo sino mas bien como diagrama conceptual de su funcionamiento el primer modelo atómico fue postulado por Demócrito planteaba que las partículas eran "indivisibles" por lo tanto no se podían dividir y las llamo átomos, pero no fue valido ya que no poseía bases científicas. Con el Modelo de Dalton que fue formulado en 1803 y 1807, permitió aclarar por primera vez por qué las sustancias químicas reaccionaban en proporciones este quilométricas fijas y por qué cuando dos sustancias reaccionan para formar dos o más compuestos diferentes, entonces las proporciones de estas relaciones son números enteros mas adelante se descubrieron las partículas subatómicas este hallazgo dio sus frutos en las manos de Dimitri Mendeléyev; con el tiempo se descubrió que los recién definidos átomos cumplían la condición de ser constituyentes de toda materia. No eran la parte más pequeña ni eran indivisibles pero se decidió que mantendrían el nombre de átomo.
Tiempo después en base a estos descubrimientos surgieron avances en los modelos atómicos como el modelo de Thomson fue propuesto en 1904 que descubrió el electrón en 1898 mucho antes que el protón y el neutrón en este modelo el átomo esta compuesto por electrones los cuales contienen la carga negativa en un átomo positivo, así como un rico pudin de pasas esta teoría decía que los electrones se encontraban por todo el átomo de carga positiva. Pero, eso no es todo, al pasar el tiempo surge el modelo de Rutherford surgió gracias a uno de sus experimentos con una lamina de oro, realizado en 1911.
Este modelo fue el primero en considerar que el átomo esta formado por dos partes: la "corteza" constituida por todos sus electrones, girando a gran velocidad alrededor de un "núcleo" muy pequeño; que concentra toda la carga eléctrica positiva y casi toda la masa del átomo.
Con los descubrimientos de Bohr la teoría de Rutherford se hace más completa y ambas se sustentan; Bohr postulo que: "Los electrones describen órbitas circulares en torno al núcleo del átomo sin irradiar energía", "No toda órbita para electrón está permitida, tan solo se puede encontrar en órbitas cuyo radio cumpla que el momento angular" y "el electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra. En dicho cambio emite o absorbe un fotón cuya energía es la diferencia de energía entre ambos niveles".
Mecánica Cuántica o Química cuántica
Esta describe matemáticamente el comportamiento fundamental de la materia a escala molecular. Una aplicación de la química cuántica es el estudio del comportamiento de átomos y moléculas, en cuanto a sus propiedades ópticas, eléctricas, magnéticas y mecánicas, y también su reactividad química, sus propiedades redox, etc., pero también se estudian materiales, tanto sólidos extendidos como superficies.
Hay diferentes formulas químicas cuánticas y estas facilitan el estudio de los átomos y el calculo de y entre los mismos; como la mecánica marcial que es una formación mecánica cuántica creada por Werner Heisenberg, Max Born y Pascual Jordán en 1925. esta fue la primera definición completa y correcta. una tesis propuesta en 1924, este trabajo presentaba por primera vez la dualidad onda corpúsculo característica de la mecánica cuántica. Su trabajo se basaba en los trabajos de Einstein y Planck.
Schrödinger desarrollo una teoría de la mecánica cuántica donde representa para las partículas microscópicas un papel análogo a la segunda ley de Newton en la mecánica clásica. Las partículas microscópicas incluyen a las partículas elementales, tales como electrones, así como sistemas de partículas, tales como núcleos atómicos .Al comienzo del siglo XX se había comprobado que la luz presentaba una dualidad onda corpúsculo, es decir, la luz se podía manifestar (según las circunstancias) como partícula (fotón en el efecto fotoeléctrico), o como onda electromagnética en la interferencia luminosa.
En 1923 Louis-Victor de Broglie propuso generalizar esta dualidad a todas las partículas conocidas. Propuso la hipótesis, paradójica en su momento, de que a toda partícula clásica microscópica se le puede asignar una onda, lo cual se comprobó experimentalmente en 1927 cuando se observó la difracción de electrones.
B. Estructura Atómica y Distribución Electrónica
Los símbolos químicos son abreviaciones o signos que se utilizan para identificar los elementos y compuestos químicos.
Algunos elementos de uso frecuente y sus símbolos son: carbono, C; oxígeno, O; nitrógeno, N 2; hidrógeno, H; cloro,Cl; azufre, S; magnesio, Mg; aluminio, Al; cobre, Cu; argón, Ar; oro, Au; hierro, Fe; plata, Ag; platino, Pt. Fueron propuestos en 1814 por Berzelius en remplazo de los símbolos alquímicos y los utilizados por Dalton en 1808 para explicar su teoría atómica.
La mayoría de los símbolos químicos se derivan de las letras griegas del nombre del elemento, principalmente en latín, pero a
veces en inglés, alemán, francés o ruso. La primera letra del símbolo se escribe con mayúscula, y la segunda (si la hay) con minúscula. Los símbolos de algunos elementos conocidos desde la antigüedad, proceden normalmente de sus nombres en latín. Por ejemplo, Cu de cuprum (cobre), Ag de argentum (plata), Au de aurum (oro) y Fe de ferrum (hierro). Este conjunto de símbolos que denomina a los elementos químicos es universal. Los símbolos de los elementos pueden ser utilizados como abreviaciones para nombrar al elemento, pero también se utilizan en fórmulas y ecuaciones para indicar una cantidad relativa fija del mismo. El símbolo suele representar un átomo del elemento en una molécula u otra especie química. Sin embargo, los átomos tienen unas masas fijas, denominadas masas atómicas relativas, por lo que también representa un mol.
Si el átomo es neutro, el número de electrones coincide con el de protones y lo da Z.
En 1913 Henry Moseley demostró la regularidad existente entre los valores de las longitudes de onda de los rayos X emitidos
por diferentes metales tras ser bombardeados con electrones, y los números atómicos de estos elementos metálicos. Este hecho permitió clasificar a los elementos en la tabla periódica en orden creciente de número atómico. En la tabla periódica los elementos se ordenan de acuerdo a sus números atómicos en orden creciente.

En química, el número másico o número de masa es la suma del número de protones y el número de neutrones. Se simboliza con la letra A. (El uso de esta letra proviene del alemán Atomgewicht, que quiere decir peso atómico, aunque sean conceptos distintos que no deben confundirse. Por este motivo resultaría más correcto que la letra A representara Atomkern, es decir, núcleo atómico para evitar posibles confusiones.) Suele ser mayor que el número atómico, dado que los neutrones del núcleo proporcionan a éste la cohesión necesaria para superar la repulsión entre los protones.
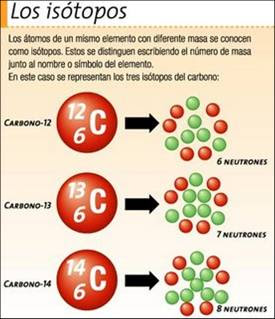
El número másico es además el indicativo de los distintos isótopos de un elemento. Dado que el número de protones es idéntico para todos los átomos del elemento, sólo el número másico, que lleva implícito el número de neutrones en el núcleo, indica de qué isótopo del
elemento se trata. El número másico se indica con un superíndice situado a la izquierda de su símbolo, sobre el número atómico. Por ejemplo, el 1H es el isótopo de hidrógeno conocido como protio. El 2H es el deuterio y el 3H es el tritio. Dado que todos ellos son hidrógeno, el número atómico tiene que ser 1.
Para todo átomo e ion:
Número másico (A) = Número atómico (Z) + Número de neutrones
A = Z + N
Para calcular la cantidad de neutrones que posee un átomo debe hacerse: "A - Z", (Número másico menos Número atómico) consultando antes en la tabla periódica las cantidades correspondientes.
La suma de los protones y los neutrones presentes en el núcleo de un átomo, nos da como resultado un número que denominamos número másico. El número másico se recoge en la tabla periódica.

Los isótopo se usa para indicar que todos los tipos de átomos de un mismo elemento químico (isótopos) se encuentran en el mismo sitio de la tabla periódica. Los átomos que son isótopos entre sí son los que tienen igual número atómico (número de protones en el núcleo), pero diferente número másico (suma del número de neutrones y el de protones en el núcleo). Los distintos isótopos de un elemento, difieren pues en el número de neutrones.

radiactivas. Los isótopos estables son los que no se descomponen con el tiempo y entre ellos se incluyen algunos isótopos de hidrógeno, oxígeno, nitrógeno, carbono y azufre.


espectroscopia de resonancia magnética nuclear (NMR).
Masa atómica
La masa atómica es la masa de un átomo, más frecuentemente expresada en unidades de masa atómica unificada. La masa atómica puede ser considerada como la masa total de protones y neutrones (pues la masa de los electrones en el átomo es prácticamente despreciable) en un solo átomo (cuando el átomo no tiene movimiento). La masa atómica es algunas veces usada incorrectamente como un sinónimo de masa atómica relativa, masaatómica media y peso atómico; estos últimos difieren sutilmente de la masa atómica. La masa atómica está definida como la masa de un átomo, que sólo puede ser de un isótopo a la vez, y no es un promedio ponderado en las abundancias de los isótopos. En el caso de muchos elementos que tienen un isótopo dominante, la similitud/diferencia numérica real entre la masa atómica del isótopo más común y la masa atómica relativa o peso atómico estándar puede ser muy pequeña, tal que no afecta muchos cálculos bastos, pero tal error puede ser crítico cuando se consideran átomos individuales. Para elementos con más de un isótopo común, la diferencia puede llegar a ser de media unidad o más (por ejemplo, cloro). La masa atómica de un isótopo puede diferir de la masa atómica relativa o peso atómico estándar en varias unidades de masa.

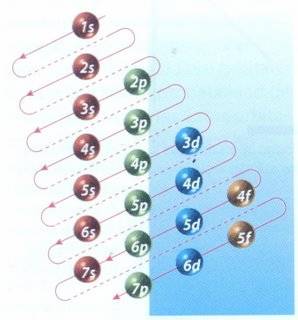
Configuración electrónica
En física y química, la configuración electrónica indica la manera en la cual los electrones se estructuran o se modifican en un átomo de acuerdo con el modelos que capas electrónicas, en el cuál las funciones de ondas del sistema se expresa como un producto de orbitales antisimitrizadas.
-Regla de Aufbau
El principio de Aufbau contiene una serie de instrucciones relacionadas a la ubicación de electrones en los orbitales de un átomo. El modelo, formulado por el físico Niels Bohr, recibió el nombre de Aufbau (del alemán Aufbauprinzip: principio de construcción) en vez del nombre del científico. También se conoce popularmente con el nombre de regla del serrucho o regla de Madelung.
-Principio de exclusión de Pauli
Esta regla establece que por cada espacio o tipo de orbital, puede contener únicamente 2 electrones, y con spin contrario. El parde electrones, tienen 3 números cuánticos iguales y difiere en el número cuántico de spin.
-Regla de máxima multiplicidad de Hund
Para entender la regla de Hund, hay que saber que todos los orbitales en una subaca deben estar ocupados por lo menos por un electrón y deben ser apareables antesde que se le asigne un segundo. Es decir, todos los orbitales deben estar llenos y todos los electrones en paralelo antes de que un orbital gane un segundo electrón. Y cuando un orbital gana un segundo electrón, éste deberá estar apareado del primero (espines opuestos o antiparalelos).
Los números cuánticos son unos números asociados a magnitudes físicas conservadas en ciertos sistemas cuánticos.
Corresponden con los valores posibles de aquellos observables que conmutan con el Hamiltoniano del sistema. Los números cuánticos permiten caracterizar los estados estacionarios, es decir los estados propios del sistema.
en los átomos, esto está basado en la teoría atómica de Niels Bohr que es el modelo atómico más aceptado y utilizado en los
últimos tiempos por su simplicidad.

A medida que se fueron descubriendo los elementos aparecía el problema de ordenarlos y clasificarlos, así, los
antecedentes de la tabla periódica se basaron en un orden establecido mediante las masas atómicas, con la carencia de no poder distinguir claramente las diferencias y semejanzas entre aquellos elementos.

-Triadas de Döbereiner
El célebre químico Döbereiner realizó en 1817 su propio informe mostrando una relación basada en la masa atómica y sus distintas propiedades químicas. Agrupó los elementos en grupos de tres, a los que denominó "triadas"
llegando a alcanzar en 1850 hasta 20 triadas ordenadas de forma coherente. Por ejemplo, podemos hablar de la triada del cloro: que corresponde al cloro, bromo e iodo.
En 1862, otro geólogo célebre, el señor Chancourtois, agrupó los elementos mediante su ley de "las octavas" afirmando que las propiedades de los elementos se repetían cada 8 elementos. Pero hoy en día se sabe que este sistema de clasificación no es correcto o solo podría utilizarse para clasificar los elementos hasta llegar al calcio. Pero al menos suponía un avance y un antecedente histórico de la tabla periódica.
En 1864, el químico inglés John Alexander Reina Newlands comunicó al Royal College of Chemistry (Real Colegio de Química) su observación de que al ordenar los elementos en orden creciente de sus pesos atómicos (prescindiendo del hidrógeno), el octavo elemento a partir de cualquier otro tenía unas propiedades muy similares al primero. En esta época, los llamados gases nobles no habían sido aún descubiertos.
El nombre de octavas se basa en la intención de Newlands de relacionar estas propiedades con la que existe en la escala de las notas musicales, por lo que dio a su descubrimiento el nombre de ley de las octavas.
En 1869 aparece en escena el famoso químico ruso Mendeleiev que por primera vez ordena los elementos de forma coherente aplicando las distintas semejanzas de los elementos. Según Mendeleiev, una vez ordenados los elementos por masas atómicas, podemos observar que ciertas propiedades mantienen una continuidad periódica, y por tanto, combinando estas dos especificaciones, Mendeleiev consiguió formar un primer esbozo o antecedente de la tabla periódica.
que les agrupase en familias. Dicha tabla periódica, por aquel entonces constaba de apenas 63 elementos y de varios huecos vacíos que el propio químico desconocía pero afirmaba su existencia. El tiempo le dio la razón varios años después.
La ley de Moseley es una ley empírica que establece una relación sistemática entre la longitud de onda de
los rayos X emitidos por distintos átomos con su número atómico. Fue enunciada en 1913 por el físico británico Henry Moseley. Tuvo una gran importancia histórica, pues hasta ese momento, el número atómico era sólo el lugar que ocupaba un elemento en la tabla periódica. Dicho lugar había sido asociado a cada elemento de modo semi-arbitario por Mendeleiev y estaba relacionado cuantitativamente con las propiedades de los elementos y sus masas atómicas.
Fue diseñado por el químico alemán J. Wener, en base a la ley de Moseley y la distribución electrónica de los elementos. Además tomo como referencia la Tabla de Mendeleev.
- Cada periodo (excepto el primero) comienza con un metal alcalino y termina con un gas noble
- El séptimo periodo esta incompleto.
- El sexto periodo es el que posee mayor cantidad de elementos (es el periodo mas largo)
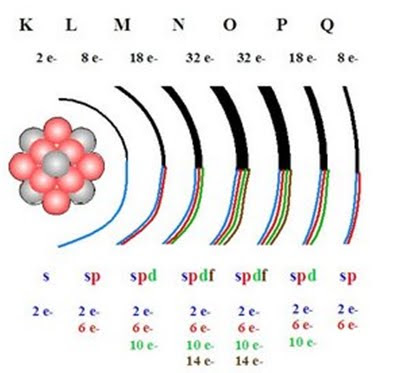
Es el ordenamiento de los elementos en columna. Estos elementos presentan similar disposición de sus electrones externos; de allí que forman familias de elementos con propiedades químicas similares.
están en orbitales “s” y/o “p”; por lo tanto sus propiedades dependen de estos orbitales.
se debe el nombre de elemento representativo.
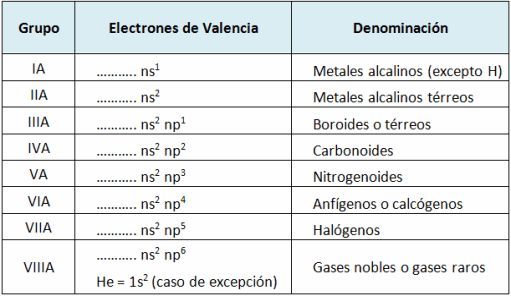
Los electrones de valencia, para un elemento representativo, es el número de electrones a nivel externo que interviene en los enlaces químicos.
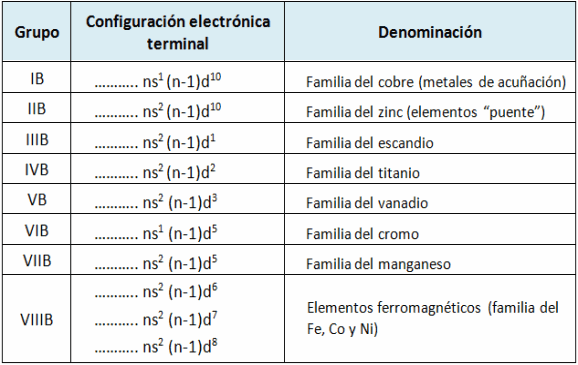
Actínidos (actinoides): comienza con el actinio (Z=87) y termina con lawrencio (Z=103), poseen propiedades semejantes al actinio.
